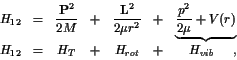Experimento Interactivo 6 de Física Estadística
Moléculas Diatómicas
El objeto de esta práctica es el estudio de las propiedades de un gas de
![]() moléculas diatómicas, cuyo hamiltomiano para el par de
átomos (1 y 2) que componen la molécula es:
moléculas diatómicas, cuyo hamiltomiano para el par de
átomos (1 y 2) que componen la molécula es:
Este Hamiltoniano puede separarse en dos partes: la parte debida al
movimiento del centro de masas de la molécula y la parte
debida al movimiento de los átomos respecto al centro de masas.
Para ello utilizamos la transformación a coordenadas relativas:
| (2) |
con lo que el hamiltoniano (1) se reescribe como:
donde ![]() es la masa total de la molécula y
es la masa total de la molécula y ![]() es la masa reducida.
Así que para la función de partición de una molécula tenemos que:
es la masa reducida.
Así que para la función de partición de una molécula tenemos que:
y la de ![]() moléculas se puede escribir como:
moléculas se puede escribir como:
A partir de esta función de partición se calcula el calor específico
por partícula como:
donde las derivadas parciales que aparecen se deben tomar a ![]() y
y
![]() constante.
constante.
Pasemos a calcular las tres funciones de partición que aparecen.
La función de partición traslacional ![]() es la de una partícula libre en 3 dimensiones:
es la de una partícula libre en 3 dimensiones:
que da una contribución al calor específico:
Vibración
La parte vibracional ![]() incluye el potencial de interacción
incluye el potencial de interacción
![]() interatómico. Si suponemos que los átomos vibran alrededor
de las posición de equilibrio
interatómico. Si suponemos que los átomos vibran alrededor
de las posición de equilibrio ![]() con pequeña amplitud
(lo que hemos asumido implícitamente en (3)),
podemos desarrollar el potencial en serie de potencias
alrededor de
con pequeña amplitud
(lo que hemos asumido implícitamente en (3)),
podemos desarrollar el potencial en serie de potencias
alrededor de ![]() , obteniendo:
, obteniendo:
donde el término en derivada primera, ![]() es nulo porque
está evaluada en
es nulo porque
está evaluada en ![]() , que es la posición de equilibrio
en la que
, que es la posición de equilibrio
en la que ![]() es mínimo.
Así pues, el potencial
es mínimo.
Así pues, el potencial ![]() se puede aproximar por un potencial armónico
de frecuencia
se puede aproximar por un potencial armónico
de frecuencia
![]() .
Por tanto, el hamiltoniano de rotación se reduce a:
.
Por tanto, el hamiltoniano de rotación se reduce a:
cuyos niveles de energía cuantizados según:
y la función de partición (que se puede calcular):
donde hemos definido la temperatura característica
de vibración como:
que suele ser del orden de cientos a miles de kelvins.
Las contribuciones al calor específico son:
Rotación
La parte rotacional, ![]() incluye el operador momento
angular
incluye el operador momento
angular ![]() , cuyas autofunciones son los
armónicos esféricos,
, cuyas autofunciones son los
armónicos esféricos, ![]() con ecuación de autovalores:
con ecuación de autovalores:
![]() , con degeneración
, con degeneración
![]() . Entonces la función de partición es:
. Entonces la función de partición es:
de donde podemos definir la temperatura característica de
rotación ![]() como:
como:
que varía entre décimas de kelvin a unos pocos kelvins
(excepto el hidrógeno).
Para temperaturas bajas comparadas con ![]() ,
, ![]() ,
podemos calcular
,
podemos calcular ![]() porque
sólo los primeros términos de la serie (5) son importantes.
Por el contrario, a temperaturas altas,
porque
sólo los primeros términos de la serie (5) son importantes.
Por el contrario, a temperaturas altas, ![]() , todos
los términos en (5) deben ser sumados.
, todos
los términos en (5) deben ser sumados.
En estos límites las contribuciones al calor específico pueden
ser calculadas, obteniéndose:
El applet en Java permite introducir las temperaturas
de rotación y traslación y el programa calcula el calor específico por
partícula (en unidades de ![]() ) representado frente a
) representado frente a ![]() .
El applet dibuja dos líneas verticales, correspondientes a
.
El applet dibuja dos líneas verticales, correspondientes a
![]() y
y ![]() y tres horizontales, que son las
contribuciones de la parte traslacional (3/2), la rotacional
(1) y la vibracional (1) cuando las temperaturas son mucho mayores
que la rotacional y la vibracional respectivamente.
y tres horizontales, que son las
contribuciones de la parte traslacional (3/2), la rotacional
(1) y la vibracional (1) cuando las temperaturas son mucho mayores
que la rotacional y la vibracional respectivamente.
Si las temperaturas características están bien separadas,
como sucede en la moléculas diatómicas reales, pueden
observarse claramente las contribuciones de los
tres hamiltonianos. El calor específico debido a la
rotación muestra un máximo alrededor de ![]() .
.
Las temperaturas características para algunas moléculas diatómicas son:
| H |
N |
CO | NO | O |
Cl |
Br |
K |
|
| 85 | 2.9 | 2.8 | 2.4 | 2.1 | 0.35 | 0.12 | 0.081 | |
| 6200 | 3340 | 3070 | 2690 | 2230 | 810 | 470 | 140 |
Fuente: Statistical Thermodynamics, J.F.Lee, F.W.Sears y D.L.Turcotte, Addison-Wesley (1963).
Pulsa
aquí
para ver una gráfica con las medidas experimentales del
calor específico a presión constante de los gases HD, HT y DT,
donde D representa el deuterio y T el tritio, frente a la
temperatura. La relación entre ![]() y
y ![]() para
gases ideales es:
para
gases ideales es: ![]() y, por ello, los resultados para
y, por ello, los resultados para ![]() están desplazados una unidad.
están desplazados una unidad.
En esta gráfica
se comparan los resultados de la
contribución vibracional al calor específico, Ec. (4) en
función de T/![]() para varios gases.
para varios gases.
Para moléculas triatómicas el análisis anterior se complica
notablemente. Por ejemplo, el CO![]() tiene 4 modos normales de vibración.
El texto de J.Kestin y J.R.Dorfman (A Course in
Statistical Thermodynamics, Academic Press, 1971) incluye una
gráfica con el calor específico de dicha molécula.
tiene 4 modos normales de vibración.
El texto de J.Kestin y J.R.Dorfman (A Course in
Statistical Thermodynamics, Academic Press, 1971) incluye una
gráfica con el calor específico de dicha molécula.